2017年高中毕业年级第三次质量预测
化学 参考答案
7.B 8.C 9.D 10.B 11.D 12.C 13.A
26.(14分)
(1)验证Cl-是否影响KI与O2的反应(2分)
(2)4I-+O2+4H+=2I2+2H2O(2分)
(3)其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强(2分)
(4)pH=10的KOH溶液(2分)
(5)电流表指针偏转,烧杯b中的溶液逐渐变蓝色(2分)
(6)3I2+6OH-=IO3-+5I-+3H2O(2分)
(7)中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-。(2分)
27.(15分)
(1)2Ga(l)+2NH3(g)=2GaN(s)+3H2(g) ΔH=-30.81 kJ•mol-1 (2分)
(2)① <(1分),该反应是放热反应,其他条件一定时,温度升高,平衡逆向移动,K减小(2分)
②增大容器体积(或减小压强)(2分)
(3) (2分)
(4)① Fe、Cu(2分)
② Ga3++4OH-=GaO2-+2H2O (2分) GaO2-+3e-+2H2O=Ga+4OH-(2分)
28.(14分)
(1)TeO2+2OH-=TeO32-+H2O(2分)
(2)3Ag + 4HNO3 = 3AgNO3 + NO↑+2 H2O(2分)
(3)溶液酸性过强,TeO2会继续与酸反应导致碲元素损失(2分);缓慢加入H2SO4,并不断搅拌(2分)
(4)TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4(2分)
(5)① 10%(2分) ②C D(2分)
35(15分).
(1)3d9(1分) N>O>S(1分)
(2)平面三角形(1分) BF3(或BCl3、BBr3等)(1分)
(3)CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高。(2分)
(4) (2分)
(5)SP3 、 SP2 (2分)
(6)①( ; ; )(1分) Cu(1分)
② ×100% (答案合理即可) (3分)
36(15分).
(1)甲苯(1分)
(2)氨基、酯基 (2分) (3)取代反应(1分)
(4) (2分)
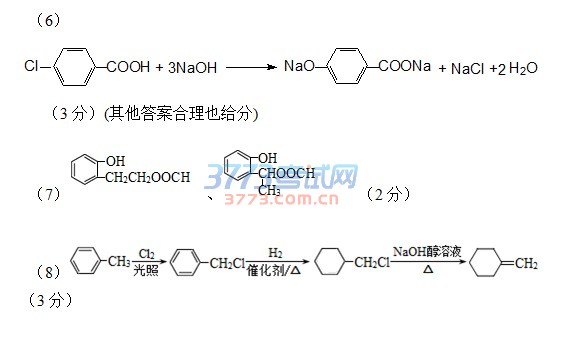
(5)a(1分)
(6)
(3分)(其他答案合理也给分)
(7) 、 (2分)
(8) (3分)